文章来源: 美柏医健 重磅!脑癌药物发展简史
前言
脑癌在所有种类肿瘤中的发病人数仅占2%,发病率排名甚至没有进入前10。脑癌难诊断、难治疗,一直是科学家们致力于攻克的焦点。脑癌分为原发性脑癌和继发性脑癌。继发性脑癌主要指其他部位肿瘤的脑转移,如肺癌脑转移、乳腺癌脑转移等。从发病部位上脑癌可分为:脑胶瘤、垂体腺瘤、神经鞘瘤、颅咽管瘤,脑膜瘤等。其中胶质瘤最普遍,占所有脑部肿瘤的27%,在恶性脑部肿瘤中占比80%。随着胶质瘤级别的升高,患者的平均生存期逐步缩短。WHO II级低级别胶质瘤患者有6.5年的生存期;WHO III级间变性胶质瘤生存期降低到3.2年;WHO IV级胶质母细胞瘤(GBM)的平均生存期只有1.2年。脑癌缺乏精准靶向治疗药,目前只有替莫唑胺(TMZ)和贝伐珠单抗2种药物获得美国FDA的上市批准用于GBM的系统治疗,存在着极大未满足临床需求。免疫检查点抑制剂、CAR-T、溶瘤病毒和肿瘤疫苗等免疫疗法,有望填补脑癌领域精准治疗的空白。
脑癌药物开发高风险
(1) 脑癌药物临床开发现状
CNS(中枢神经系统)疾病,是指神经退行性疾病、功能性紊乱、CNS感染等,包括阿尔茨海默症、帕金森症、抑郁症、精神分裂症、癫痫,以及原发性脑瘤和脑转移癌等。相比于其他治疗领域,CNS领域药物开发呈现出高风险的特点,从临床I期到上市的成功率仅为8.4%。而肿瘤药物从临床I期到上市的成功率只有5.1%。脑癌药物既属于CNS领域,也属于肿瘤领域。因此,它的开发风险极大。据统计,脑癌药物的临床失败率近60%,图1统计了不同临床开发阶段及状态的脑癌药物个数,大部分脑癌药物在临床阶段终止开发。
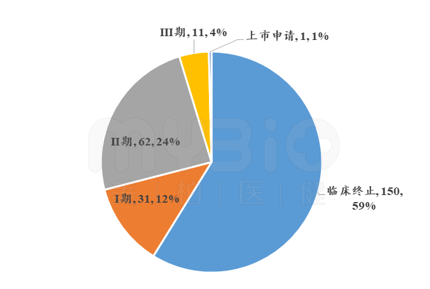
▲图1 脑癌药物不同临床状态及阶段的数量分布/个
来源:Datamonitor数据库
(2) 脑癌领域药企竞争格局
鉴于CNS脑癌药物开发的高风险,很少有Biotech公司会贸然介入此领域,甚至不乏一些MNC关闭CNS药物研发中心,比如GSK就于2017年关闭了CNS全球研发中心。图2统计了脑癌临床试验开展数量TOP10的制药企业情况。TOP10公司全部为MNC,涉及默沙东、罗氏、诺华、BMS、辉瑞、阿斯利康、卫材等,并没有见到Biotech公司的身影。
▲图2 脑癌药物临床试验开展数量TOP10制药企业
来源:Datamonitor数据库
虽然脑癌药物开发风险极大,但是存在着极大的市场空间。据统计,2014年全球脑胶质瘤药物的市场规模达到6.59亿美元,2024年将在此基础上增加到33亿美元,年复合增长率高达17%。中国Biotech公司赞荣医药和壁辰医药均专注于脑癌药物的管线布局及研发。赞荣医药利用对DMPK的独特理解,致力于开发原创性、高血脑屏障穿透力的小分子入脑抗癌药。其研发的ZN-A-1041是一款潜在的HER2+晚期乳腺癌脑转移的治疗药,目前处于临床I期。壁辰医药同样专注于入脑抗癌药物的开发。其研发的ABM-1310是一款BRAF抑制剂,在临床前试验中显示出高穿脑活性,目前处于临床I期。此外,于今年递交了科创板IPO的索元生物,专注于肿瘤领域和CNS领域疾病开发药物,管线布局中涉及到2个脑癌品种:DB102(PI3K抑制剂,一线GBM,III期)和DB107(Toca511+Toca FC,溶瘤病毒与小分子组合药,二线GBM,寻找生物标志物阶段)。这两个品种均来自于引进及合作开发。索元生物管线还布局了精神分裂症、抑郁症、阿尔茨海默症等CNS疾病。
(3) 脑癌药物开发难点—血脑屏障
1895年,Ehrlich博士首次发现血脑屏障(blood-brain barrier)现象。他将蓝色染料通过静脉注入动物体内后发现,除大脑外几乎所有器官都变成了蓝色。上世纪60年代电子显微镜出现后,科学家才直接观察到了血脑屏障。血脑屏障就是指脑毛细血管壁与神经胶质细胞形成的血液与脑组织之间的屏障,其主要由血管内皮细胞、星形胶质细胞、周细胞、细胞外连续的基底膜和细胞外基质及神经元构成。血脑屏障能够防止毒素及其他外源性有害物质进入脑内损害神经细胞,并且维持着脑功能所需物质的摄入,使内环境稳定以维持神经细胞的正常功能。新生儿的血脑屏障尚未发育成熟。如大脑中的P-gp(P-糖蛋白)表达在出生时非常有限,会随着年龄增长而逐步增加,并在3-6个月时达到成人水平。因为出生后血脑屏障上P-gp的表达量过低,吗啡会通过新生儿的血脑屏障并在大脑中蓄积,带来毒副作用。研究表明,母亲在哺乳期使用可待因会导致新生儿出现阿片类药物毒性,甚至危及生命。
由于血脑屏障的存在,几乎所有的大分子和98%以上的小分子药物都无法进入脑实质。药物分子进入脑实质主要通过以下途径:a.被动扩散,大部分小分子都是通过这一途径入脑,但是会受到主动外排的限制;b.通过细胞间隙入脑,这种方式只适用于极性低分子量的化合物;c.脑内皮细胞表达的转运蛋白介导的摄取,如肽转运体、转铁蛋白受体等;d.脑内皮细胞表达的受体蛋白介导的转运,通过受体介导的转运方式能使大分子顺利入脑,如胰岛素受体可转运胰岛素样生长因子进入脑实质。通过内源性血脑屏障转运系统能有效的穿透血脑屏障并靶向脑部肿瘤进行药物递送,为脑癌的治疗提供了一种安全有效的方法。目前与脑癌相关研究最多的是TfR1(转铁蛋白受体)、LAT1(大型中性氨基酸转运蛋白1)、AChR(乙酰胆碱受体)、LRP1和LRP2(低密度脂蛋白受体)等。
研究发现,CNS疾病均会对血脑屏障产生影响,如原发性/转移性脑癌会造成血脑屏障的渗漏。临床上也观察到脑瘤患者脑部的药物暴露量会更高。乳腺癌患者接受拉帕替尼治疗后,发生脑转移的患者脑部的拉帕替尼浓度高于未发生脑转移的患者脑部浓度。一些大分子抗体药物,如赫赛汀(曲妥珠单抗)在脑转移病人的脑脊液中蓄积更高。这些现象均说明脑部肿瘤会破坏血脑屏障的完整性。
在脑癌新药研发中选择合适的动物模型起着至关重要的作用。大鼠SOA(Short oral absorption)试验是筛选入脑化合物时常用的动物模型,通过比较化合物在大脑与血液的浓度比值来判断它的入脑程度。某研究中化合物的被动扩散较好,例如Papp(表观渗透系数)> 5*10-6 cm/s,也并非人体P-gp的底物,但在此大鼠模型中并未发现足够的脑部暴露量,很可能的原因是该化合物是大鼠P-gp底物,尽管P-gp在人体和大鼠的同源性非常高,但仍然存在着种属差异。血脑屏障种属差异的存在,导致临床前动物试验并不能很好的指导人体脑癌药物临床研究。

脑癌的流行病学分析
(1) 发病率和死亡率a. 趋势
中国脑胶质瘤年发病率为5-8/10万,5年病死率仅次于胰腺癌和肺癌。脑胶质瘤发病机制尚不明确,目前确定的危险因素包括:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。虽然脑癌的发病率显著低于其他细分瘤种,但是难诊断、难治疗,致死率极高。2018年全球各国脑癌的发病率见图3。
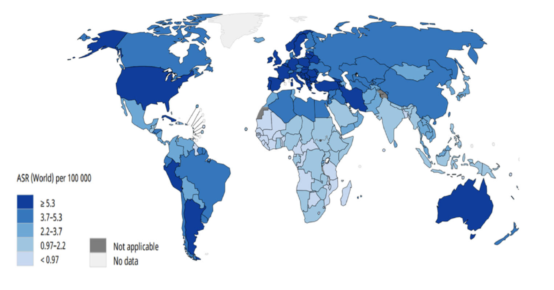
▲图3 全球2018年脑癌发病率(人/100,000)
来源:The association between incidence and mortality of brain cancer and human development index (HDI): an ecological study. BMC Public Health 20, 1696 (2020).
中国癌症患者2000-2015年间发病率的变化趋势见图4。脑癌的发病率呈平缓升高趋势,女性相较男性而言增长较明显。
▲图4 中国各类癌症发病率2000-2015年变化趋势:A男性;B 女性
来源:Cancer incidence and mortality in China, 2015, Journal of the National Cancer Center, https://doi.org/10.1016/j.jncc.2020.12.001
中国癌症死亡率2000-2015年变化趋势见图5。中国脑癌患者的死亡率在过去15年间几乎没有什么变化。
▲图5 中国各类癌症死亡率2000-2015年变化趋势:A男性;B女性
来源:Cancer incidence and mortality in China, 2015, Journal of the National Cancer Center, https://doi.org/10.1016/j.jncc.2020.12.001
b. 生存率
脑癌患者的减寿年数约22年,在所有癌症减寿年数中排名第4位。前3位分别是:睾丸癌、宫颈癌和霍奇金淋巴瘤。分析其原因,主要是因为脑癌难诊断和治疗。脑癌的分级从最轻者(I级)到侵袭力最强(IV级),生存率呈下降趋势。I级脑癌患者生存率最高,1年生存率高达96%,5年生存率约92.5%。IV级脑癌患者的生存率最低,1年生存率为26%,5年生存率只有2.5%。早期诊断可以延长患者的生存时间。
▲图6 不同种类肿瘤的减寿年数对比
来源:脑癌的流行病学分析[J].世界科学,2018(12):2+65.
(2) 东西方差异
尽管检测和治疗技术都有所进步,但脑癌所致的死亡人数在过去30年内没有什么变化。澳大利亚、加拿大、法国、英国、美国的脑癌死亡率远远大于日本,这些国家脑癌死亡率呈平稳波动趋势,具体见图7。包括中国、日本在内的亚洲国家,脑癌死亡率明显低于西方国家,可能是因为人口的基因差异。
▲图7 1980-2010年六国脑癌死亡率变化趋势对比
来源:脑癌的流行病学分析[J].世界科学,2018(12):2+65.
脑癌的常规治疗
GBM(胶质母细胞瘤)是CNS脑部肿瘤里最常见的、侵袭性最高的恶性肿瘤,占所有原发性脑瘤的15%,占所有胶质瘤的54%。GBM患者按基因型分为两类:IDH(异柠檬酸脱氢酶)野生型和突变型。90%的GBM患者呈IDH野生型,这类患者基本为临床上原发或新发GBM,年龄多发于55岁以上;IDH突变型占10%,由低级别弥漫性胶质瘤发展而来,多发于年轻患者。目前GBM的标准治疗包括:手术切除、放疗、化疗和综合治疗。
手术切除可延长患者的生存期,并获得肿瘤标本用来进行病理学诊断和分子遗传学检测。为了最大范围安全切除肿瘤,常采用神经导航、术中神经电生理监测和术中MRI实时影像等新技术。放疗可杀灭或抑制肿瘤细胞,延长患者生存期,常规分割外照射是脑胶质瘤放疗的标准治疗。GBM术后放疗联合TMZ(替莫唑胺)同步并辅助化疗,已成为成人新诊断GBM的标准疗法。
美国FDA近年只批准了2种药物用于GBM患者的系统治疗:TMZ获批上市用于新诊断GBM患者的治疗;贝伐珠单抗获批上市治疗复发性GBM患者。但是在现有疗法下,GBM患者仅获得了14.6个月的中位生存期,5年生存率低于5%。
▲来源:胶质母细胞瘤的治疗现状. 临床医学进展, 2020, 10(12): 2875-2882.
备注:Gliadel:卡莫司汀聚合物晶片(可生物降解);PCV:洛莫司汀+甲基苄肼+长春新碱;Gliadel(卡莫司汀聚合物晶片)可产生严重颅内感染、颅内高压和脑脊液泄漏等并发症。因此不作为临床推荐使用。
脑癌免疫疗法进展
(1) 脑癌免疫疗法作用机制
因为血脑屏障的存在,淋巴细胞极少能进入大脑。因此大脑被认为拥有“免疫特权”。但是随后研究发现,大脑并没有完全地和血液中的免疫细胞相隔离。大脑中的抗原可以通过硬脑膜和脑膜中的淋巴管流入颈部淋巴结。小胶质细胞作为大脑的常驻免疫细胞,可以作为一种抗原呈递细胞(APC)起作用,并且颈部淋巴结中的T细胞被激活后可通过脑脊液(CSF)进入脑实质。
GBM肿瘤细胞通过多种方式发挥免疫抑制作用。一方面,GBM肿瘤细胞可以分泌各种细胞因子或趋化因子,这些因子可以影响巨噬细胞极化,促进调节性T细胞募集,抑制DC(树突状细胞)和NK(自然杀伤)细胞的功能。另一方面,GBM肿瘤细胞能够表达免疫抑制分子,如表达的PD-L1可阻止T细胞的增殖和活化。
2021年Cancer Cell发布了一项研究成果,揭示了脑癌中起关键作用的生物图谱。丁莉教授团队对近百例GBM患者开展了调查分析,绘制了GBM发生发展过程中起关键作用的基因、蛋白、浸润细胞和信号通路的详细图谱。研究人员根据免疫细胞的类型和数量,将GBM划分为4种不同类型。1型GBM含有大量的巨噬细胞和少量T细胞;2型含有中等数量的巨噬细胞;3型含有大量的T细胞和少量的巨噬细胞;4型为“免疫沙漠”,即不含有任何类型的免疫细胞或者数量很少。这一发现揭示了GBM患者大多对免疫治疗无明显疗效的原因。以巨噬细胞为目标的免疫疗法如CD47疗法等,可能对1型有效,但是对4型无效。4种不同免疫亚群的存在,可能是GBM免疫治疗截至目前大样本III期临床均呈阴性的根本原因之一。
GBM的免疫疗法主要包括:免疫检查点抑制剂、疫苗、CAR-T细胞疗法和溶瘤病毒疗法。未来GBM的治疗方向在于:免疫疗法,与放化疗,以及作用于肿瘤微环境的分子靶向治疗的联合应用。脑胶质瘤各种疗法的作用机制见图8。
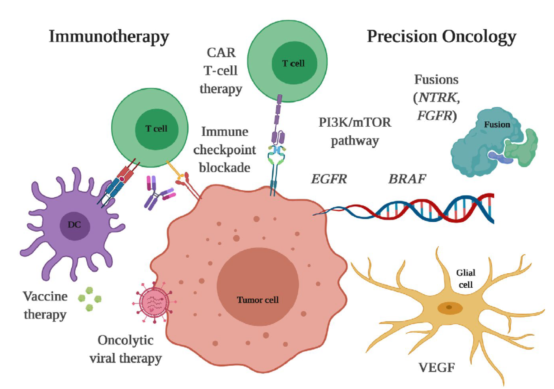
▲图8 脑胶质瘤的免疫疗法和靶向治疗
来源:Management of Glioblastoma: State of the Art and Future Directions. CA CANCER J CLIN 2020;70:299–312
(2) PD-1/L1a. 临床研究最新进展
截至目前,全球上市的PD-1/L1抗体药物,均未获批用于脑胶质瘤的治疗;PD-1/L1曾经针对GBM开展的III期临床也均以失败告终。
CheckMate143是首个PD-1治疗GBM的大样本随机III期临床试验。对比O药(Nivolumab)和贝伐珠单抗的疗效数据,结果显示未达到主要临床终点OS(mOS:9.8月vs10.0月;mPFS:1.5月vs3.5月)。但是在MGMT甲基化GBM、且未使用皮质类固醇的患者中,O药与贝伐珠单抗对比的mOS为:17.0月vs10.1月,结果表明这类患者可能获益于免疫检查点抑制剂。但受样本量的限制,该部分患者是否能从O药治疗中获益仍需进一步临床研究。
CHECKMATE498是一项针对MGMT非甲基化新诊断GBM患者的III期临床,O药联用放疗与TMZ联用放疗作对比的OS并无延长。而针对MGMT甲基化新诊断GBM患者的另一项III期临床CHECKMATE548结果显示,O药+放疗+TMZ组与TMZ+放疗组的PFS相比无延长,OS结果未公布。默沙东曾经开展一项II期临床试验,研究K药(Pembrolizumab)与贝伐珠单抗联用治疗复发性GBM的疗效,最终获得了4.1个月的mPFS和8.8个月的mOS 。
值得关注的是:新辅助PD-1单抗治疗能成功逆转复发性GBM肿瘤微环境的免疫抑制性,增强局部及全身的抗肿瘤免疫应答,提高局部免疫细胞浸润。NCT02550249是一项II期临床,旨在评价O药用作复发性GBM患者的新辅助治疗的疗效。临床结果显示:O药成功激起了患者的免疫应答,增强了趋化因子的转录表达,提高了免疫细胞浸润数量;O药作新辅助治疗后的mPFS达4.1个月,mOS达7.3个月;其中2例患者PFS分别达到28.5个月、33.3个月。
免疫检查点抑制剂(PD-1/L1、CTLA-4)已完成的极具代表性的临床研究,见表2。
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.
GBM患者中MGMT启动子未甲基化比例可高达50-70%。MGMT甲基化的GBM患者对放化疗敏感,这类患者的标准疗法为Stupp方案(同步放化疗+6个周期TMZ辅助化疗)。而此方案对于MGMT未甲基化GBM患者的临床存在着争议。然而虽然存在争议,但是此类患者的优先治疗依然采用TMZ。目前MGMT是否甲基化在高级别胶质瘤中可作为预后判断指标,但是不能作为治疗效果指标。
一项针对新诊断MGMT未甲基化的GBM患者的II/III期临床试验(NCT04396860)正在进行中,旨在对比Ipilimumab+O药+放疗联合疗法与TMZ+放疗的疗效差异。K药治疗GBM的临床研究,除了单独使用K药,更多的是将K药与TMZ、放疗及贝伐珠单抗的联合应用;K药与TMZ、放疗的联用主要治疗新诊断的GBM患者;与贝伐珠单抗的联用主要用于复发性GBM患者。
截至目前获批上市的PD-L1抑制剂包括durvalumab,atezolizumab和avelumab,未曾开展针对脑胶质瘤的III期临床研究。在曾经开展的临床I/II期试验中,也并没有获得阳性结果。Durvalumab曾经开展的一项II期临床(NCT02336165),共招募了159名GBM患者,这是全球首项PD-L1单抗用于GBM的临床研究。此项临床旨在评价Durvalumab联用基础放疗对于新诊断MGMT未甲基化GBM患者的疗效,以及Durvalumab联用贝伐珠单抗用于复发性GBM的疗效。临床结果显示:Durvalumab联合放疗治疗新诊断的MGMT未甲基化GBM患者疗效良好,40名入组患者的中位随访时间为24.5个月(截至2018年11月5日),1年生存率达50%。
PD-1/L1针对GBM正在开展的临床试验见表3。
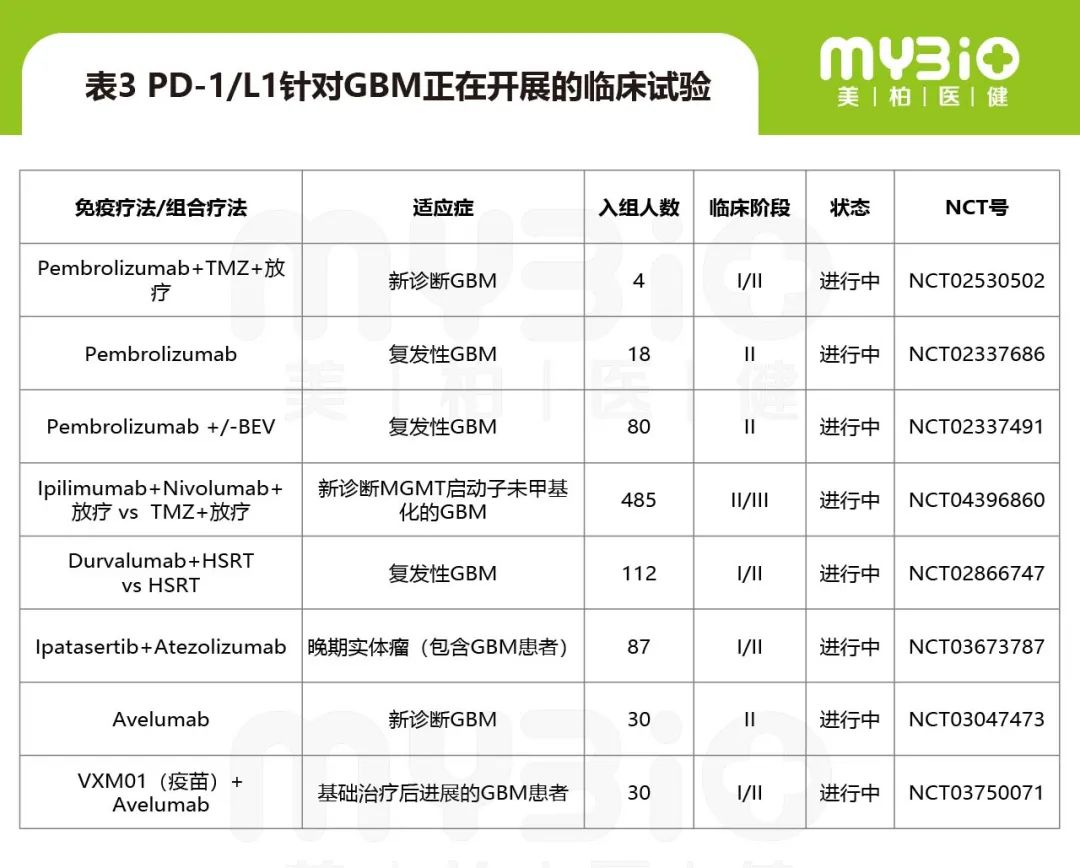
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911. ClinicalTrials.gov
备注:TMZ:替莫唑胺;BEV:贝伐珠单抗;HSRT:Hypofractionated stereotactic radiation therapy,即大分割立体定向放射治疗。
b. 开发受阻的原因和趋势
肿瘤细胞PD-L1表达强度、肿瘤浸润淋巴细胞(TIL)、微卫星不稳定性(MSI)及DNA错配修复缺陷等,均会影响PD-1/L1单抗的疗效。GBM中TIL常呈耗竭状态,且数量较为稀少,而TIL的存在是免疫检查点抑制剂起效的基础。研究表明,具有高突变负荷、高新抗原负荷的肿瘤更易激发机体免疫。基于Barresi等的一项研究,在18–54岁、野生型IDH的GBM患者中分离出特殊的超突变(TML>9个突变/Mb)亚群,超突变患者OS与非超突变患者相比显著延长,提示GBM中的超突变患者具有更好的预后。
PD-1/L1抗体在针对GBM的III期临床研究中并没有表现出优效性。分析其原因,可能包括以下几点:肿瘤免疫原性不足;克服免疫抑制性微环境的能力不足;免疫检查点抑制剂不能通过血脑屏障并原位破坏免疫检查点信号等。因此,PD-1/L1疗法的联合应用可能对GBM的治疗更有效。2018年哈佛大学的研究者发现,表达PD-1抗体(scFvPD-1)的新型溶瘤性单纯疱疹病毒(oHSV)可以增强抗肿瘤效果。在临床前动物试验中,这种新型溶瘤病毒延长了GBM小鼠的中位生存期,而且诱导产生了抗肿瘤的记忆反应。这项发现为将溶瘤性HSV-1的肿瘤内局部应用与PD-1阻断的原位表达相结合的策略提供了支持。
综上,中国临床指南中不推荐抗PD-1疗法应用于MGMT非甲基化新诊断的GBM患者,也不推荐用于复发性GBM患者。目前抗PD-1新辅助治疗推荐用于复发性GBM患者的临床研究。
(3) CAR-T细胞疗法a. CAR-T疗法发展历程
CAR-T(嵌合抗原受体T细胞免疫疗法),是一种通过人体自身免疫细胞来杀死肿瘤的免疫细胞疗法。先从癌症患者PBMC(外周血单个核细胞)中分离出T细胞;在实验室中将T细胞进行基因工程改造,具体是:抗CD3和抗CD28的抗体刺激T细胞激活;利用基因工程将能特异识别肿瘤细胞的CAR结构转入T细胞;改造后的T细胞进行体外培养、扩增至治疗所需剂量,一般为十亿至百亿级别;化疗清淋预处理然后回输CAR-T细胞,观察疗效病严密监测不良反应。这就是CAR-T疗法的基本流程。
2017年,诺华研发的CTL-019(商品名Kymriah)获得美国FDA的批准上市,治疗急性淋巴细胞白血病,开创了免疫细胞治疗癌症的先河,CAR-T细胞疗法自此进入商业化时代。CAR-T技术发现于1986年,至今已有30多年的历史。2012年7岁白血病女孩埃米利的治愈,使CAR-T疗法引起了空前的关注。截至目前,全球共批准上市了6款CAR-T疗法。据统计,难治性血液肿瘤患者在目前疗法没有特别有效的情况下,使用CAR-T疗法的有效率高达50%-70%。CAR-T疗法治疗脑癌的作用机制见下图9。
▲图9 CAR-T细胞免疫疗法治疗脑癌的作用机理
来源:Brain immunology and immunotherapy in brain tumours. Nat Rev Cancer 20, 12–25 (2020).
b. 临床研究最新进展
CAR-T细胞疗法针对GBM的临床研究靶点主要为:HER2、IL‐13Rα2和EGFRvⅢ等。首个自体HER2-CAR-CMV-T细胞疗法用于GBM的临床试验中,取得了24.5个月的中位总生存期。这是一项入组了16名GBM患者的I期临床。首个靶向IL‐13Rα2的I期临床,共入组了3例复发性GBM患者。术后在患者瘤腔内注射CAR‐T细胞后,1例患者肿瘤细胞的IL‐13Rα2表达量下调,1例患者的注射部位肿瘤坏死体积增加。mOS达11个月。首个靶向EGFRvⅢ CAR‐T临床I期试验,对10例MGMT非甲基化的复发性GBM患者静脉输注CAR‐T细胞,mOS只有8个月。首个前瞻性、多中心随机对照的研究CIK细胞疗法用于新诊断GBM患者的III期临床中,取得了22.5个月的中位总生存期。针对GBM患者作细胞疗法研究的已完成的临床情况,见表4。
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.
备注:CMV:巨细胞病毒
靶向EGFRvⅢ的CAR-T疗法,开展了一项I/II期临床研究(NCT01454596),入组患者为EGFRvIII阳性的恶性胶质瘤,计划入组107人;针对新诊断GBM人群的EGFRvⅢ CAR-T疗法开展了一项I期临床(NCT02664363),计划入组48人。更多的针对GBM进行的CAR-T细胞疗法临床试验信息,见表5。
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.
c. 开发受阻的原因和趋势
综上,CAR‐T疗法治疗脑癌的开发难点,与其他种类实体瘤具备的共性原因主要包括:肿瘤的异质性体现在不同患者对CAR-T细胞疗法的响应率不同;实体瘤微环境不仅包含Treg(调节性T细胞)、TAM(肿瘤相关巨噬细胞)等多种具有免疫抑制能力的细胞,还会过度表达TGFβ、IL-10、IL-4等细胞因子,而这些细胞因子具有免疫抑制作用。这些因素构成的实体瘤微环境会显著降低CAR-T细胞的效力。因此如何避免实体瘤微环境中的免疫抑制,且长时间维持局部CAR‐T细胞的水平便是需要解决的难题。而脑癌使用CAR-T治疗的特性问题在于,如何有效的透过血脑屏障进而发挥疗效,或者说如何有效输注细胞进入脑实质,如输入脑脊液治疗GBM等;此外,如何避免出现细胞因子风暴等严重副作用而又不影响CAR-T疗法的效力,则是CAR-T治疗所有肿瘤的普遍关注问题。因此,CAR-T用于脑癌的治疗仍需要更多的临床探索研究。
(4) 肿瘤疫苗a. 多肽疫苗
多肽疫苗约由8-30个氨基酸组成。它们的结构设计中通常包括TSA(肿瘤特异性抗原)或TAA(肿瘤相关抗原)。TSA来源于肿瘤细胞表达的突变体上,而非来自于正常细胞;TAA则来源于肿瘤细胞和正常细胞中正常蛋白的过表达。与其他实体瘤不同的是,GBM的突变水平相对较低,因此只有很少的TSA可以应用于抗脑癌多肽疫苗的结构设计中。抗脑癌研发的多肽疫苗包括单靶点疫苗、多靶点的复合疫苗及个体化疫苗。
针对GBM设计的单靶点疫苗主要涉及EGFRvⅢ、survivin和IDH等靶点。Rindopepimut是一种靶向于EGFRvⅢ位点的多肽疫苗,其联合TMZ治疗EGFRvⅢ阳性GBM患者的III期临床以失败告终,与单药TMZ相比联用疗法并没有增加患者的总生存期。
SurVaxM疫苗由美国MimiVax公司开发,是一款全球首创的模拟肽肿瘤疫苗,可以靶向survivin蛋白。Survivin是一种抗凋亡蛋白,在多种恶性肿瘤中高表达,包括95%的脑胶质瘤、多发性骨髓瘤、肾癌等。SurVaxM疫苗能够同时激活T细胞和B细胞免疫,以及抗体介导的survivin通路抑制,从而发挥细胞和抗体介导的双重抗肿瘤作用。通过激活免疫系统杀死survivin阳性肿瘤细胞,阻止肿瘤增殖并起到预防或延缓肿瘤复发的作用。
2019年ASCO数据显示,在一项国际多中心II期临床试验(NCT02455557)中,SurVaxM疫苗对新诊断GBM 患者治疗的mPFS以及mOS分别为15.5个月和30.5个月。而接受标准疗法的新诊断GBM患者的5年生存期低于5%,mOS为14.6个月,SurVaxM延长了一倍以上的中位生存期。此项研究结果给GBM患者治疗带来了新希望。2019年11月,复星医药与MimiVax公司签订SurVaxM疫苗的独家许可协议。复星医药和MimiVax将共同开发SurVaxM在美国和中国的商业化。根据协议,MimiVax还将获得1000万美元的预付款,这将部分用于即将在中美进行的关键性临床试验。
IMA-950含有11个肿瘤相关肽,是一种新型的GBM特异性治疗疫苗。临床I期结果显示,在HLA-A2阳性的新诊断GBM患者中,免疫应答率达30%。其中发生注射部位反应的患者mOS明显高于未发生注射部位反应的患者:26.7月vs13.2月。
采用个体差异多靶点疫苗PPV(personalized peptide vaccine)的首个Ⅲ期临床试验以失败告终。研究者针对每位患者的抗原表达情况,在12种抗原肽中选取4种制备疫苗,对88例复发性GBM进行治疗,试验组和安慰剂组的PFS和OS均无明显差别。此外研究发现,SART2-93为临床获益的不利因素,SART2-93阴性的患者相对OS较长。
针对GBM研究的疫苗已完成的代表性临床试验,见表6。
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.
备注:DC:树突状细胞;CMV:巨细胞病毒;HSPPC-96:热休克蛋白肽复合物96;GSC:胶质瘤干细胞
b. DC疫苗
DC(树突状细胞)是人体内重要的抗原递呈细胞之一。DC细胞转运至淋巴结,通过MHC Ⅰ类和Ⅱ类分子提呈肿瘤抗原给CD8+T细胞和CD4+T细胞,诱导肿瘤特异性免疫反应。人体中枢神经系统中缺乏DC细胞,研究者将DC细胞进行体外改造、扩增后回输给患者,有望增强免疫系统识别及杀伤胶质瘤的能力。胶质瘤存在多种TAA(肿瘤相关抗原)的过表达,如HER2,IL13Rα2,gp100,MAGE-1,TRP-2和AIM-2,利用这些TAA致敏自体DC细胞制成疫苗并回输。这就是DC疫苗治疗GBM的基本原理。
一项临床研究入组了16名新诊断GBM患者,给予自体DC疫苗注射后6名患者没有肿瘤复发迹象,mPFS和mOS分别达16.9个月和38.4个月。此研究证实自体DC疫苗能有效杀伤胶质瘤细胞。在一项DC疫苗用于GBM治疗的IIa期临床试验(NCT01567202)中,结果显示IDH1野生型、TERT突变和B7‐H4低表达的GBM患者均能从DC疫苗激活的特异性主动免疫中获益,且安全性良好。而后在一项国际多中心的III期临床(NCT0045968)中,DC疫苗能够显著提高GBM患者的生存期。接受DC疫苗治疗后,30%的患者生存期超过30个月,24.2%的患者生存期超过36个月。
DC疫苗AV-GBM-1进行了一项二期临床,主要用于新诊断GBM患者的研究。AV-GBM-1由自体DC携带着自体肿瘤抗原组成,这些抗原是从术后肿瘤组织中分离出来的。57名患者在半年时间内注射了8剂AV-GBM-1疫苗。2021年公开的临床结果显示,使用此疫苗治疗后的mPFS达10.4个月,明显高于标准疗法(放疗+TMZ治疗mPFS为6.9个月)。
VBI-1901是一款抗CMV(巨细胞病毒)疫苗,于2021年6月获得美国FDA授予的快速通道资格,用于治疗首次复发性GBM患者。CMV抗原在90%以上的GBM中特异性表达,而在正常大脑细胞不表达。一项IIa期临床试验中,一组10名患者使用VBI-1901+GM-CSF(粒细胞巨噬细胞刺激因子)佐剂治疗后1年总生存率为60%,半年总生存率为80%,疾病控制率达40%。另一组9名患者使用VBI-1901+GSK的AS01B佐剂系统治疗后,半年总生存率为89%。GBM患者复发后的治疗手段少,历史对照数据表明半年总生存率约60%,1年的总生存率约30%。
针对GBM正在开展的DC疫苗的部分临床试验见表7。
▲来源:Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.
(5) 溶瘤病毒a. 溶瘤病毒发展历程及上市产品
溶瘤病毒的研发历程已经走过30年。1991年,哈佛大学医学院通过对HSV-1(单纯疱疹病毒)进行基因工程改造,能够使其在胶质瘤细胞中选择性复制并且在动物模型中表现出良好的疗效,至此进入通过基因改造病毒基因组开发溶瘤病毒抗肿瘤的新时代。2005年,由上海三维生物公司开发的重组人5型腺病毒注射液在中国批准上市,用于鼻咽癌患者的后线治疗。美国FDA于2015年批准上市了首个溶瘤病毒产品,即安进基于HSV-1病毒开发的T-VEC(Imlygic)用于治疗晚期黑色素瘤患者。至此,众多MNC纷纷加入溶瘤病毒的战局中来。
脑瘤在临床治疗上由于对放化疗不敏感,再加上血脑屏障的影响,使得治疗手段非常有限,因此能够选择性杀伤肿瘤的溶瘤病毒是一种潜在的治疗手段。2021年日本批准上市了全球首款用于原发性脑瘤的溶瘤病毒疗法:Delytact(teserpaturev/G47?)。此次批准基于一项II期单臂试验,受试者为经过放疗和TMZ治疗后难治性或复发性的GBM患者。试验的中期结果显示,Delytact达到了一年生存率的主要终点。此次批准是条件性限时批准。Delytact是由日本第一三共和东京大学基于HSV-1联合开发的一款溶瘤病毒。通过对HSV基因组进行基因工程修饰,增强Delytact在肿瘤细胞中复制的选择性,并且在肿瘤细胞裂解的同时激活人体的抗肿瘤免疫反应,从而增强溶瘤病毒的抗肿瘤活性。此疗法曾获得日本厚生劳动省授予的先驱疗法认定。Delytact作用机理见图10。
▲图10 Delytact抗脑癌的作用机理
来源:Oncolytic HSV-1 G207 Immunovirotherapy for Pediatric High-Grade Gliomas. N Engl J Med 2021; 384:1613-1622.
b. 临床研究最新进展
目前针对GBM开展临床研究的溶瘤病毒种类多样,包括腺病毒(如VB‐111等)、风疹病毒(如MV‐CEA等)、单纯疱疹病毒(如HSV G207等)、重组非致病性脊髓灰质炎‐鼻病毒嵌合体(PVSRIPO)、逆转录病毒(如TOCA 511)等。
2018年美国杜克大学的研究人员,将PVSRIPO病毒进行改造后用于复发性GBM的治疗。在其开展的I期临床中,共入组了61名患者。经过改造后的病毒能特异性入侵CD155表达的胶质瘤细胞,并增殖最终导致肿瘤细胞的裂解。溶瘤病毒治疗组的中位生存期达12.5 个月,与历史疗法相比并无显著提高。但是治疗组2年和3年的生存率均达到21%,而历史生存率只有4%。表明经过溶瘤病毒治疗后,生存率提高到原来的5倍。
美国癌症研究协会9(AACR)2021年会上,公布了一项针对儿童脑瘤的重磅临床结果。这项I期临床共入组了12名7-18岁的高级别胶质瘤患者,旨在评价溶瘤病毒G207的疗效和安全性。G207是一款基于HSV-1改造的溶瘤病毒,结果显示其在治疗儿童和青少年高级别胶质瘤的mOS达到12.2个月,与常规治疗相比生存期延长了1-2倍。儿童脑瘤患者中有8%-10%的人群属高级别胶质瘤。这部分儿童患者,在接受标准放化疗后3年无事件生存率仅为11%-22%,并且复发后的平均生存期只有5.6个月。
此外,常规疗法可能会对儿童患者的大脑发育造成不可逆损伤。受限于胶质瘤体细胞突变低、肿瘤高异质性、免疫沉默以及血脑屏障等多种因素,儿童高级别胶质瘤的治疗亟需新突破。而此项试验表明溶瘤病毒有望用于儿童高级别胶质瘤的治疗。G207溶瘤病毒针对复发性GBM患者的II期试验预计在今年启动,可关注后续进展。
然而针对GBM的溶瘤病毒的临床研究并不是一帆风顺的。基于逆转录病毒开发TOCA511溶瘤病毒虽然在I期临床中疗效数据表现良好,但是其首个III期临床以失败告终。临床结果表明:术后复发GBM患者使用TOCA511+TOCA FC治疗,未能延长患者的生存期(试验组vs标准治疗组的OS:11.1个月vs12.2个月)。TOCA511是一种编码胞嘧啶脱氨酶基因的逆转录病毒载体,注入瘤体后入侵胶质瘤细胞,随后会表达胞嘧啶脱氨酶,这种酶能将通过血脑屏障的TOCA FC(5-氟胞嘧啶)转变成5-FU(5-氟尿嘧啶),从而消除血脑屏障对5-FU的限制。索元生物于2020年收购了基因治疗先驱Tocagen公司(TOCA.US)的核心资产,包括逆转录病毒复制载体平台和相关管线产品的全球权益。由此获得了Toca511和Toca FC药物组合(现名DB-107)除中国(包括港澳台)以外的全球权益。索元生物计划通过其特有的全基因扫描技术平台,寻找经独立验证的可预测药效的生物标志物,进而重新开展以生物标志物为指导的DB-107国际多中心临床研究。DB-107目前正在处于寻找生物标志物阶段。据Cortellis数据库记载,此项交易金额仅有115万美元。
VB‐111针对复发性GBM患者的III期临床GLOBE同样以失败告终。VB-111与贝伐珠单抗联用组的疗效不如贝伐珠单抗组。mOS对比为:6.8个月vs7.9个月;mPFS对比为:3.4个月vs4.7个月。VB‐111是一种基于腺病毒改造的搭载了FAS‐TNF受体1嵌合基因的溶瘤病毒,通过双重机制抗肿瘤。它入侵胶质瘤细胞后会表达一种TNF受体和Fas构成的融合蛋白。这种融合蛋白能够导致内皮细胞的凋亡,抑制血管增生,从而导致胶质瘤细胞死亡并且释放肿瘤特异性新抗原。另外,腺病毒能够激活机体的免疫反应,招募T淋巴细胞到胶质瘤附近。
c. 开发受阻的原因
临床上溶瘤病毒治疗脑癌仍然需要攻克众多难关,主要问题包括:如何进行颅内多次给药;如何克服给药后病毒复制引发局部炎症反应导致的脑水肿;单次给药的临床终点如何设计;静脉给药如何突破血脑屏障并且靶向性地到达肿瘤部位等。
d. 溶瘤病毒与免疫疗法联用
OncoMyx Therapeutics基于粘液瘤病毒开发的一款新型溶瘤病毒疗法。其在SITC2020会议上公布的临床前数据首次证实,溶瘤病毒与免疫检查点抑制剂联合静脉或瘤内给药后,能显著减缓多种肿瘤的生长,而且联用时抗肿瘤效果更佳。
OncoMyx通过基因编辑使粘液瘤病毒携带了3个基因:1个调节T细胞和NK细胞活性以及招募的细胞因子基因、1个可重塑肿瘤微环境以及消除肿瘤细胞对T细胞免疫抑制的基因,以及1个促炎因子基因。新基因编辑后的粘液瘤病毒抗癌效果增强。这种多基因粘液瘤病毒与PD-1或PD-L1抑制剂联合使用时,增加了CD8/Treg细胞和M1/M2巨噬细胞比例,增强了抗肿瘤免疫作用。此款溶瘤病毒在GBM动物模型C57BL/6J中,呈现了良好的抗肿瘤活性。与TMZ联用治疗时显著提高了小鼠的生存期。
综上,溶瘤病毒治疗脑瘤未来的开发方向主要是与其他疗法的联合应用。溶瘤病毒激活机体抗肿瘤免疫反应的特性意味着,如果溶瘤病毒与其他免疫疗法如PD-1/L1等免疫检查点抑制剂联用,极有可能提高抗癌效力。此外,对溶瘤病毒进行转基因改造使其携带更有效的免疫治疗基因组合,有望增强溶瘤病毒的单药疗效。
继发性脑癌治疗进展
(1) NSCLC脑转移治疗进展
临床上发现的大部分继发性脑癌的原发癌是肺癌,近30%患者存在NSCLC(非小细胞肺癌)合并脑转移。NSCLC发生脑转移后自然生存期只有1-2个月,传统的手术、立体定向放疗及全脑放疗也只能达到3-6个月的生存期。这类患者的治疗方式,主要包括手术、放化疗、靶向治疗及免疫治疗等。临床上的标准疗法为放疗,但是治疗效果欠佳。靶向药与放化疗联合应用、免疫疗法等开始成为探索的主要方向。
a. EGFR-TKI治疗肺癌脑转移
单用EGFR-TKI治疗肺癌脑转移
EGFR-TKI的上市,极大提高了EGFR突变阳性NSCLC患者的生存期。目前临床应用的EGFR-TKI包括吉非替尼、埃克替尼、厄洛替尼、阿法替尼、奥希替尼等。以吉非替尼为代表的第一代EGFR-TKI,只对EGFR L858R和exon19 del突变的肺癌患者有效。经过吉非替尼治疗后约80%的患者会出现T790M突变,对第一代EGFR-TKI产生耐药,以奥希替尼为代表的第三代EGFR-TKI应运而生。多项临床研究表明EGFR-TKI对NSCLC脑转移患者的疗效,明显优于放化疗。表8对比了EGFR-TKI药物治疗NSCLC脑转移患者的疗效数据。
▲来源:非小细胞肺癌脑转移治疗进展[J]. 中国现代医生,2020,58(14):182-187,192.
备注:此表只挑选了EGFR-TKI代表药物作疗效对比,且疗效数据来源于文献披露的若干临床结果。
EGFR-TKI与放疗联用
研究发现,全脑放疗联合EGFR-TKIs治疗NSCLC脑转移患者,能够延长患者无进展生存期,获得更高临床疗效。某项研究共收治了80名NSCLC脑转移患者。这些患者均接受相同全脑放疗,观察组每天服用吉非替尼持续治疗1个月;对照组给予含铂类为主的二联方案化疗,持续化疗2个周期(1个化疗周期为3周)。此研究表明吉非替尼与放疗联用可以产生协同的生物学效应。吉非替尼是一种脂溶性良好的EGFR抑制剂,可以一定程度的通过血脑屏障,能够有效治疗NSCLC脑转移灶。吉非替尼能够阻断细胞周期,抑制新生血管的生成,加快肿瘤细胞的凋亡,同时放疗提高了血脑屏障的通透性,有利于吉非替尼通过血脑屏障。结果显示,观察组治疗后总有效率为65%,明显高于对照组的47.5%,差异有统计学意义;同时观察组无进展生存期、总生存时间均长于对照组。PFS对比为12.23vs9.88(月);OS对比为28.54vs23.41(月)。
b. 免疫疗法治疗肺癌脑转移
PD-1/L1、CTLA-4等免疫检查点抑制剂相继上市以来,免疫疗法已经成为驱动基因突变阴性晚期NSCLC 脑转移的重要治疗方法。
O药(Nivolumab,PD-1抗体)已经批准上市作为驱动基因突变阴性的晚期NSCLC免疫疗法。在一项O药与多西他赛作对照治疗NSCLC患者的研究中,O药与多西他赛相比有更长的中位生存期(mOS:12.2vs9.4/月),3/4级不良反应发生率10%,远低于多西他赛的54%。回顾性研究中发现O药在治疗晚期NSCLC脑转移患者与无脑转移患者的生存获益相似。
K药(Pembrolizumab,PD-1抗体)同样已经批准上市作为PD-L1阳性或者不限定PD-L1阳性的晚期NSCLC的一线疗法。耶鲁大学一项II期临床试验,入组了34例NSCLC脑转移患者,共有18例患者完成随访,mOS达到7.7个月,颅内及整体ORR均为33%,可见K药对于NSCLC脑转移患者颅内外病灶的ORR是一致的。Di等报道了2例EGFR阴性的晚期NSCLC脑转移患者接受K药治疗后获得了部分缓解,且无明显相关不良事件发生。以上研究均验证了K药在NSCLC脑转移治疗上的有效性。然而K药与其他治疗方式联用能否给NSCLC脑转移患者带来更大疗效,仍需进一步研究。
Atezolizumab是一种人源化的PD-L1单克隆抗体,通过阻断PD-L1与PD-1/B7-1的结合而重新激活机体抗肿瘤免疫反应。它已经批准上市用于晚期NSCLC的治疗。一项III期临床研究,旨在评估Atezolizumab对照多西他赛用于一二线治疗失败的晚期NSCLC患者的疗效对比,共入组了85名NSCLC脑转移患者。结果显示,Atezolizumab治疗组与多西他赛化疗组相比,疾病进展风险降低了39%,死亡风险减少45%,且有显著总生存获益。
目前关于免疫疗法治疗NSCLC脑转移患者的临床数据较少,缺乏大样本的临床数据支持,因此免疫疗法对于NSCLC脑转移患者的疗效仍需要进一步探索。
(2) 乳腺癌脑转移治疗进展
乳腺癌是女性最为常见的恶性肿瘤,10%-20%的晚期乳腺癌患者会发生脑转移。BCBM(乳腺癌脑转移)占所有继发性脑癌的15%-20%,仅次于肺癌。BCBM的病理分型以TNBC(三阴性乳腺癌)和HER2阳性为主。BCBM的发生发展的具体机制不明。肿瘤细胞与神经元和胶质细胞的相互作用在脑转移灶的增长中起着关键作用。BCBM的局部治疗手段包括手术、立体定向放射外科治疗(SRS)和全脑放射治疗(WBRT)。局部治疗对脑转移灶的针对性更强、起效更快,但是不良反应较为严重。系统治疗主要包括:化疗、内分泌治疗、免疫疗法及靶向治疗等。针对不同分型的乳腺癌脑转移,采取的系统治疗有所区别。
a. HER2阳性BCBM治疗进展
HER2阳性BCBM的治疗药物主要为HER2靶向药以及酪氨酸激酶抑制剂。HER2靶向药主要包括:单克隆抗体、ADC和HER2小分子抑制剂。
上市的HER2靶向抗体药物:曲妥珠单抗、帕妥珠单抗、T-DM1(ADC,曲妥珠单抗偶联微管抑制剂DM1)和DS-8201(ADC,曲妥珠单抗偶联拓扑异构酶I抑制剂deruxtecan)。
曲妥珠单抗在未接受过放疗的BCBM患者的脑脊液与血浆中的浓度比为1∶420,放疗或手术可使其比例增加,但效果有限。对于软脑膜转移患者,可通过鞘内注射曲妥珠单抗使其绕过血脑屏障从而在脑脊液中达到起效浓度,从而延长生存期。在临床I期试验中(NCT00543504),10例BCBM患者中6例PFS超过半年,其中1例PFS超过1年,且未发生脑转移相关的不良反应。帕妥珠单抗+曲妥珠单抗+紫杉醇是目前HER2阳性乳腺癌的一线标准疗法。研究表明,帕妥珠单抗联用曲妥珠单抗与单用曲妥珠单抗对比,发生脑转移的时间延长(15vs11.9 月),且脑转移患者的总体生存期也显著延长(OS:34.4vs26.3月)。
临床上T-DM1作为HER2阳性晚期乳腺癌的二线标准疗法使用。III期临床中(EMILIA试验),入组了95例接受过治疗、无症状的BCBM患者。结果显示:与拉帕替尼联合卡培他滨相比,T-DM1显著延长了BCBM患者的总生存期(OS:26.8vs12.9月)。此外,T-DM1联合放疗、高能聚焦超声治疗、马西替坦等都在BCBM中取得了较好的疗效。DS-8201是继T-DM1上市后的第2款HER2靶向ADC品种。在II期临床试验DESTINY-Breast01中,184例既往接受过T-DM1治疗的转移性乳腺癌患者,经过DS-8201治疗后mPFS达16.4个月,ORR达60.9%;其中24例既往接受过治疗、无脑转移相关症状的BCBM患者,mPFS达18.1个月。
小分子TKI对于BCBM的治疗进展见表9,主要涉及HER2小分子抑制剂、CDK4/6抑制剂和PARP1/2抑制剂等。
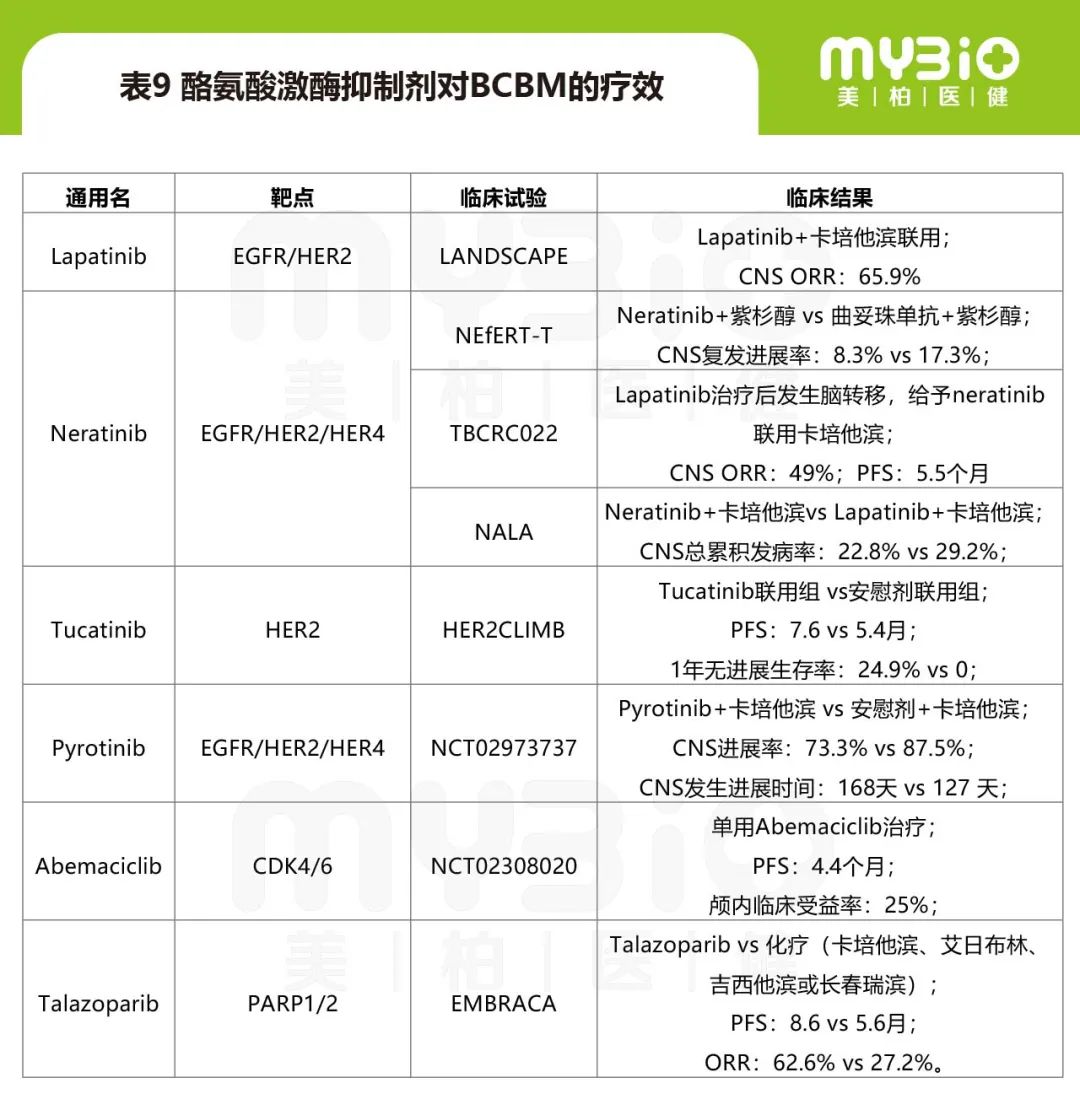
▲来源:乳腺癌脑转移系统治疗的研究进展[J]. 上海交通大学学报(医学版)2021,41(5):671-677.
b. HR阳性BCBM治疗进展
HR阳性乳腺癌的治疗手段主要为内分泌疗法。但是内分泌疗法对于BCBM的作用尚不明确。虽然他莫昔芬亲脂性较强,容易通过血脑屏障,但是脑转移发生时患者可能已经对内分泌疗法耐药了。并且脑转移灶中HR的表达状态有40%与原发灶是不一致的。约50%的HR阳性乳腺癌患者经过内分泌治疗后出现耐药,这种情况下使用CDK4/6抑制剂去进一步治疗。目前上市的CDK4/6抑制剂中,Abemaciclib的血脑屏障渗透力较强。一项II期临床结果显示,经过多线治疗后的BCBM患者给予Abemaciclib治疗,CNS的ORR为6%,mPFS为4.4个月,临床获益率25%。
c. TNBC脑转移治疗进展
TNBC侵袭性强,预后极差。主要采用化疗、抗血管生成药物,PARP抑制剂和免疫疗法等。
化疗药方面,研究表明顺铂联合依托泊苷、环磷酰胺、长春瑞滨和吉西他滨对BCBM患者有效。一项II期临床证实,伊立替康联合TMZ治疗脑转移或软脑膜转移进展的患者有效。
抗血管生成药物方面,阿帕替尼和贝伐珠单抗等在多种亚型BCBM中都呈现出较好的疗效。在某项II期试验中贝伐珠单抗联合卡铂或者联合依托泊苷和顺铂,CNS的ORR分别达63%和77%。PARP抑制剂中Talazoparib在某项临床研究中与化疗对比在BCBM患者中的无进展生存期显著延长(8.6个月vs5.6个月),ORR 提高(62.6%vs27.2%)。
免疫疗法中,在某项TNBC的III期临床中入组的902例TNBC患者中,61例是脑转移患者,采用Atezolizumab/安慰剂+白蛋白紫杉醇治疗。结果显示,与安慰剂组相比,Atezolizumab组的PD-L1阳性患者的总生存期延长(OS:25个月vs18个月),但PD-L1阴性的患者几乎没有生存获益(19.7个月vs19.6个月)。
国内本土脑癌开发品种概括
胶质母细胞瘤(GBM)是最致命的脑肿瘤类型,占所有原发性脑肿瘤的15%和所有神经胶质瘤的54%,年发病率为10万之5。标准治疗主要为手术切除和放化疗。标准疗法的中位生存期是14.6个月,平均5年生存率小于5%。脑癌缺乏精准靶向治疗药,存在着极大未满足临床需求。国内本土药企针对GBM作的管线布局,主要涉及分子靶向疗法、免疫检查点抑制剂、细胞免疫疗法等方向。表10汇总了国内药企针对GBM所作的品种布局。
▲来源:Pharmacodia数据库及公开信息;此表仅呈现针对脑癌开发的国内本土在研品种,或有遗漏欢迎读者学习交流。
备注:TOP1:DNA拓扑异构酶I;GCLC:Gamma-glutamylcysteine synthetase inhibitors,γ-谷氨酰半胱氨酸合成酶抑制剂。
(1) PI3K/AKT/mTOR抑制剂
PI3K(磷脂酰肌醇3-激酶)在人体中参与多种细胞功能的调节,包括细胞增殖、分化、凋亡和葡萄糖转运等。PI3K 位于众多重要信号通路的关键信号位,通过活化下游AKT、mTOR等位点形成的 PI3K-AKT-mTOR通路,可促进肿瘤细胞运动及转移。PI3K通路几乎介导了50%恶性肿瘤的发生。PI3K靶点抑制剂一直是全球各大制药公司的开发热点。PI3K 分为I型、II型和III型,只有I型与肿瘤关系最为密切,II型、III型主要控制膜运输、间接调节信号转导等功能。I型PI3K包括4个催化亚基:PI3Kα、PI3Kβ、PI3Kδ、PI3Kγ。PI3Kα、PI3Kβ在多种细胞中表达,PI3Kδ、PI3Kγ仅在免疫系统中表达。I型PI3K的4个催化亚基的结构相似且下游通路大体一致,如果单纯抑制单一亚型可能会因为肿瘤细胞内的代偿机制而产生耐药。
因此早期各大药企主要围绕pan-PI3K抑制剂进行开发。但是经过临床研究发现pan-PI3K抑制剂会引发严重的毒副作用。究其原因是,该靶点相关通路不仅控制着很多肿瘤的标志性特性以及肿瘤微环境的维护,而且在正常组织中也发挥着重要作用。大部分推进至临床后期的pan-PI3K抑制剂均以失败告终。只有拜耳的Copanlisib于2017年获得美国FDA的上市批准,用于治疗复发性滤泡性淋巴瘤。以及阿诺医药的BKM120处于临床三期(头颈癌)。此后,众多药企转而开发特异性PI3K抑制剂以降低副作用。
截止目前,全球共批准上市了5款PI3K抑制剂。分别为:Idelalisib(吉利德,PI3Kδ)、Copanlisib(拜耳,PI3Kα/δ)、Duvelisib(Secura Bio,PI3Kδ/γ)、Alpelisib(诺华,PI3Kα)和Umbralisib(TG Theraps,PI3Kδ)。上市PI3K抑制剂获批的适应症,只涉及淋巴瘤和乳腺癌,尚未涉及脑癌等其他肿瘤。
Paxalisib是一款PI3K/AKT/mTOR通路小分子抑制剂,因其出色的血脑屏障穿透能力,在一项II期试验中,针对术后切除、经过TMZ等初始放化疗的GBM患者,给予Paxalisib作辅助治疗,表现出更好的疗效。mOS达17.7个月,mPFS达8.5个月。已知TMZ标准治疗仅能达到12.7个月的mOS和5.3个月的mPFS。因此,Paxalisib有望获批上市作为复发难治性GBM患者的一线疗法。先声药业于2021年3月与Kazia Therapeutic签订独家许可协议,获得Paxalisib在大中华地区(中国大陆、香港、澳门和台湾)所有适应证开发及商业化权益。Kazia保留其他所有地区开发和商业化权利,并将按计划继续推动包括在中国开展的GBM AGILE关键研究。Kazia将获得1100万美元首付款,针对GBM适应症Kazia将获得2.81亿美元的里程碑付款;针对GBM以外的适应症,Kazia还将进一步获得里程碑付款。此外,先声药业将再向Kazia支付其商业销售额的13%作为特许权使用费。此项交易金额破19亿元人民币。至此,先声药业开始介入脑癌管线布局。
索元生物正在美国、中国、加拿大同步进行DB102的III期临床(ENGAGE)。在新诊断GBM并且DGM1阳性的患者中,评估DB102联用TMZ同步放化疗加辅助化疗方案对照安慰剂的OS优效性。计划国内入组100人,国际入组318人。FDA曾于2020年授予DB102治疗GBM的快速审评通道。DB102是一款全球首创的PI3K/AKT/PKCβ小分子抑制剂,能够直接诱导肿瘤细胞死亡且阻碍肿瘤细胞增殖,以及间接抑制肿瘤诱导的血管生成。索元生物于2014年从礼来获得此品种的全球开发、生产和销售的全部权利(包含所有的知识产权)。礼来曾开展了60多项DB102针对多种肿瘤的临床研究,共计3000多名患者接受其治疗,获得大量的安全性及疗效数据。但是在关键性的III期PRELUDE临床中并未达到预期疗效。索元生物对PRELUDE临床样本进行大规模的基因组学分析后,发现可预测药效的生物标志物DGM1,DGM1阳性患者在服用DB102后其生存期有显著改善。随后索元生物开展DB102用于一线治疗DLBCL的国际多中心的临床III期试验(ENGINE)。2021年4月索元生物将DB102的部分海外权益授权给Aytu BioPharma,获得1亿美元的里程碑及销售提成。DB102如获成功,将用于一线治疗GBM。
国内有多家药企均开发了PI3K抑制剂,包括索元生物、信达生物、正大天晴、和记黄埔等,但是目前开发的肿瘤适应症大多集中在淋巴瘤和乳腺癌等。预测国内将由先声药业或索元生物开启PI3K抑制剂在脑癌领域的破冰。国内PI3K领域竞争格局见表11。
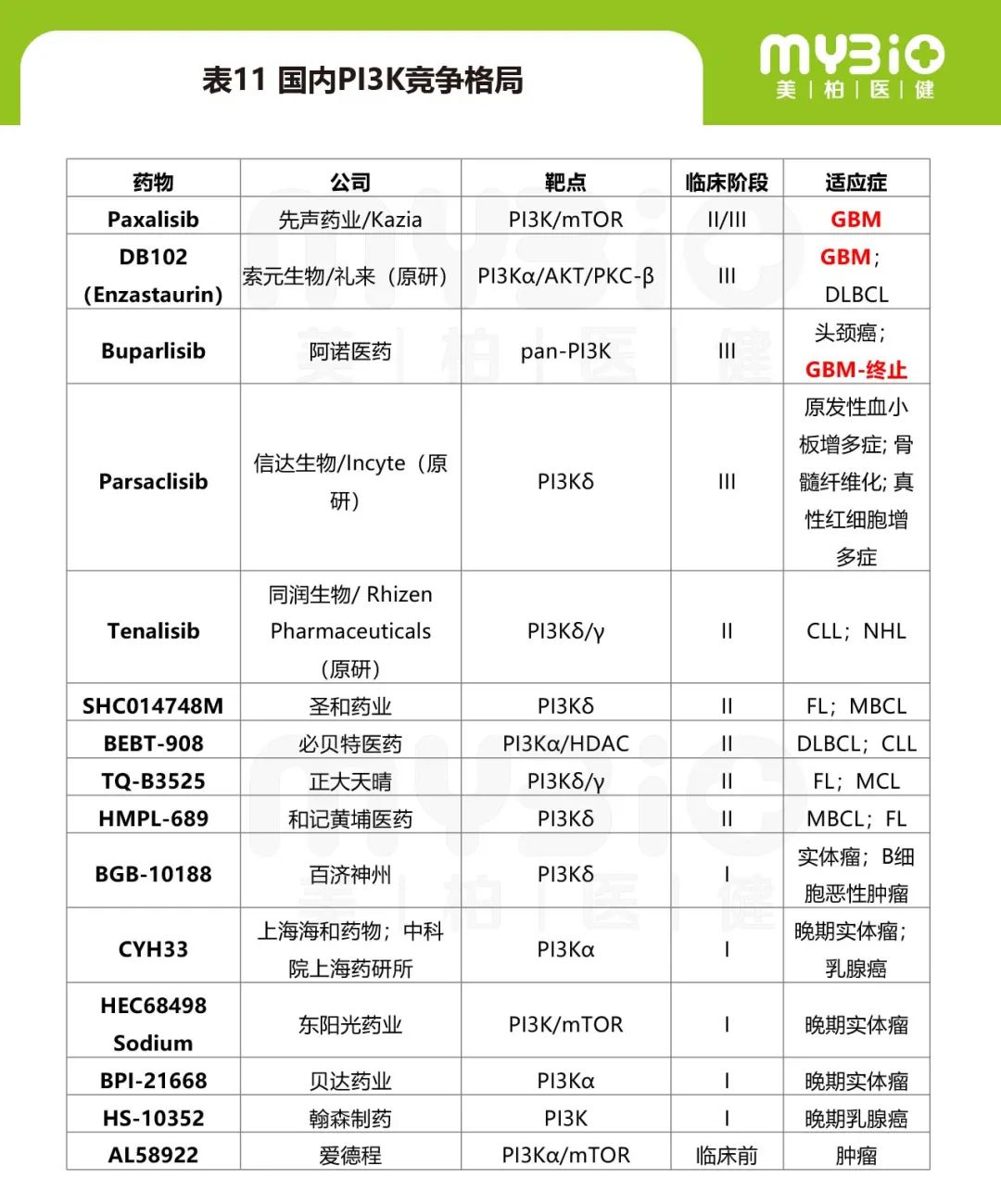
▲来源:公开信息整理,或有遗漏欢迎补充交流。
备注:DLBCL:弥漫性大B细胞淋巴瘤;CLL:慢性淋巴细胞白血病;NHL:非霍奇金淋巴瘤;FL:滤泡性淋巴瘤;MBCL:边缘区 B 细胞淋巴瘤;MCL:套细胞淋巴瘤。
(2) MET抑制剂
MET(间质上皮转化因子)编码的蛋白c-MET,是可以与HGF(肝细胞生长因子)结合的一种受体酪氨酸激酶。c-MET通路正常表达时促进组织的分化与修复,调节异常时导致肿瘤细胞的增殖与转移。MET通路异常包括MET 14号外显子跳跃突变、MET扩增、重排和MET蛋白过表达。MET通路异常激活在脑癌、肺癌、肝癌等多种实体瘤中发生。
全球迄今为止共批准上市了2款MET抑制剂:诺华的卡马替尼(Capmatinib)和默克的特泊替尼(Tepotinib)。卡马替尼于2020年5月获得美国FDA批准上市,一线及后线治疗MET14外显子跳跃突变的转移性NSCLC患者。特泊替尼于同年3年在日本获批上市治疗MET 14外显子跳跃突变的不可切除的晚期复发性或转移性NSCLC患者。卡马替尼曾经开展的一项联合BKM120(PI3K抑制剂,III期)治疗复发性GBM的I/II期临床研究(NCT01870726),最终因联用疗效不佳而中断。卡马替尼正在进行一项Ib期临床研究(NCT02386826),旨在评价其联用贝伐珠单抗治疗GBM的疗效和安全性,预计2022年完成临床。另一款上市的MET抑制剂特泊替尼,目前尚未开展GBM或其他脑癌的临床研究。
此外,辉瑞开发的多靶点(MET/ALK/Ros1)小分子上市药物克唑替尼,针对GBM开展的临床研究处于I期。武田制药上市的卡博替尼同为一款多靶点(MET/VEGFR1/VEGFR 2/VEGFR3/ROS1/RET/AXL/NTRK/KIT)激酶抑制剂,其针对脑癌、脑转移的临床研究处于II期。我们可关注已上市的MET抑制剂未来在脑癌领域是否能取得突破。
国内药企对MET抑制剂的开发,涉及小分子、单抗、双抗及ADC等。包括:沃利替尼(和黄医药,上市),伯瑞替尼(浦润奥生物)、谷美替尼(海和生物)、HS-10241(豪森药业),博昔替尼(东阳光),SHR-A1403(恒瑞,ADC)、HLX55(复宏汉霖,单抗)以及MCLA-129(贝达药业引进,EGFR/c-MET双抗)等。目前只有沃利替尼获批上市治疗NSCLC。和黄医药针对沃利替尼的开发适应症,主要为NSCLC和胃癌及胃食管癌,目前尚未涉及脑癌。其他临床在研的MET小分子抑制剂中,只有伯瑞替尼和博昔替尼针对脑癌开展了临床试验。而这几款MET靶向的抗体药物目前均处于临床I期,也并未开展针对脑癌的相关临床研究。
MET小分子抑制剂伯瑞替尼,最初由Crown Bioscience研发,后来浦润奥生物与CBT pharmaceuticals(从Crown Bioscience剥离)达成了合作开发协议,由浦润奥负责国内开发,CBT负责除中国以外地区的开发。它于2021年2月被CDE纳入突破性治疗品种,用于c-MET外显子14突变的NSCLC的治疗。伯瑞替尼开展了一项II/III期临床试验(CTR20181664),旨在评价其用于ZM融合基因阳性继发性GBM的疗效和安全性。此试验计划招募84名受试者,对照组是替莫唑胺/顺铂/依托泊苷,以OS为主要试验终点,以PFS、ORR为次要终点,目前正在进行中。ZM融合基因是继发性GBM恶性进展的关键驱动因子。伯瑞替尼通过抑制其下游的c-Met从而发挥抗肿瘤作用。此外,伯瑞替尼针对NSCLC的临床研究处于临床II期。
东阳光药业开发的博昔替尼,同为一款MET小分子抑制剂。目前处于临床I期,开发的适应症包括胶质瘤在内的多种实体瘤。然而,东阳光已经很久未披露此品种的临床进展及开发计划,因此它的最新进展目前未可知。
(3) PD-1/L1抗体
恒瑞医药研发上市的卡瑞利珠单抗(PD-1),于2019年获得NMPA的批准上市,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤患者的治疗。卡瑞利珠单抗针对NSCLC、乳腺癌等的开发处于临床III期,针对GBM的开发处于临床II期。一项II期临床(NCT04952571),旨在评价卡瑞利珠单抗联用贝伐珠单抗治疗复发性GBM患者的疗效和安全性。计划招募94名受试者,主要临床终点为半年无进展生存率,次要临床终点为OS、PFS、ORR等。此项临床预计2024年底完成。另一项II期临床(NCT04888611),旨在评价卡瑞利珠单抗单用或与DC疫苗联用作为复发性GBM的新辅助治疗。此临床研究计划招募40人,预计2024年初完成试验。恒瑞还开展了一项II期研究(NCT04583020),旨在评价卡瑞利珠单抗对于新诊断GBM患者的疗效。计划招募42人,预计2023年底完成试验。
国际上PD-1/L1曾经开展的针对GBM的III期临床试验,均以失败告终。国内自主研发上市的PD-1药企中除了恒瑞以外,其他几家如百济神州、君实生物、信达生物和康方生物等,目前均未对自家的PD-1品种开展针对脑癌的临床研究,大多集中在NSCLC、乳腺癌等市场空间更大的瘤种上。恒瑞的策略则是采用PD-1与贝伐珠单抗、DC疫苗等其他免疫疗法相组合,可关注其针对GBM开展的多项II期临床结果。
(4) 细胞免疫治疗
科济生物的管线中有一款靶向EGFRvIII的CAR-T产品(KJ-C2112),主要针对GBM作开发,目前还未开展临床研究。马力喏也有一款靶向EGFRvIII的CAR-T产品,主要针对GBM作开发,但是目前临床开展情况未知。
一项I期临床(NCT03347097),旨在评价一种PD1-TIL细胞疗法对于复发性GBM的疗效和安全性,目前尚未启动招募。此项研究由上海细胞治疗研究院和华山医院的研究者发起。基因改造TIL疗法、TIL疗法联合其他免疫治疗等,将会是胶质瘤免疫治疗的一个新方向。
B7-H3 CAR-T疗法已经进入临床阶段,目前有2项针对GBM的临床研究,一项是针对复发难治性GBM患者的临床试验(NCT04077866),另一项是针对儿童胶质瘤(NCT04185038)的试验。这两项临床预计分别于2024年和2026年完成试验,后续可跟进临床最新进展。
茂行科技是一家聚焦于脑部肿瘤通用型CAR-T研发的公司,2021年8月刚完成天使+轮融资。在一项由PI发起的临床试验中,经茂行科技研发的通用型CAR-T治疗的3例复发性GBM患者,ORR(客观有效率)达100%。据披露目前该公司布局了多个针对脑部肿瘤的靶点管线,但均处于临床前早期开发阶段。
其他
肿瘤电场治疗仪爱普盾®在2020年5月获得中国NMPA的上市批准,与TMZ联用治疗新诊断GBM患者,以及单一用于复发性GBM的治疗。它的原理是通过低强度、中频的交流电场,作用于微管蛋白从而干扰肿瘤细胞有丝分裂,促使肿瘤细胞的凋亡并抑制肿瘤增殖。一项国际多中心临床试验显示,相比于单用TMZ治疗,电场疗法联用TMZ治疗新诊断GBM,mOS由16个月延长至20.9个月,五年生存率由5%提升至13%。而后中国开展的电场治疗GBM的临床试验中,共入组29名新发GBM患者,15名复发GBM患者。结果显示,新发GBM患者mPFS为6.4个月,mOS尚未达到;复发GBM患者mPFS达到4.5个月,mOS达8.6个月;在安全性方面,最常见的不良反应是轻度至中度皮肤刺激,均为I-II级。
再鼎医药于2018年从Novocure公司获得了爱普盾®的大中华区的独家商业化与开发合作授权。据披露,再鼎为此次独家授权合作支付了1500万美元,加上后续研发支持等费用,最终将达到7800万美元,分成约为净销售额的10%至15%。据再鼎2020年报披露,爱普盾®的销售收入达1640万美元,是再鼎医药目前营收的主要来源之一。
【参考文献】
(下滑查看)
1. 脑胶质瘤诊疗规范(2018年版)
2. 汪红艳,刘煜. 受体介导靶向恶性脑胶质瘤递送系统的研究进展[J]. 药物资讯, 2018,7(2): 27-32.
3. 脑癌的流行病学分析[J]. 世界科学, 2018(12): 2+65.
4. S. Zhang, K. Sun, R. Zheng et al., Cancer incidence and mortality in China, 2015, Journal of the National Cancer Center, https://doi.org/10.1016/j.jncc.2020.12.001
5. Khazaei, Z., Goodarzi, E., Borhaninejad, V. et al. The association between incidence and mortality of brain cancer and human development index (HDI): an ecological study. BMC Public Health 20, 1696 (2020). https://doi.org/10.1186/s12889-020-09838-4
6. Sampson, J.H., Gunn, M.D., Fecci, P.E. et al. Brain immunology and immunotherapy in brain tumours. Nat Rev Cancer 20, 12–25 (2020).
7. Wang et al. Proteogenomic and metabolomic characterization of human glioblastoma. Cancer Cell. 2021,39(4): 509-528. https://doi.org/10.1016/j.ccell.2021.01.006
8. Management of Glioblastoma: State of the Art and Future Directions. CA CANCER J CLIN 2020;70:299–312
9. 李壮, 杨军, 苏文. 胶质母细胞瘤的治疗现状[J]. 临床医学进展, 2020, 10(12): 2875-2882.
10. Perry, J.R., Laperriere, N., O’Callaghan, C.J., et al. (2017) Short-Course Radiation plus Temozolomide in Elderly Patients with Glioblastoma. The New England Journal of Medicine, 376, 1027-1037.
11. Reardon DA, Brandes AA, Omuro A, et al. Effect of Nivolumab vs Bevacizumab in Patients With Recurrent Glioblastoma: The CheckMate 143 Phase 3 Randomized Clinical Trial. JAMA Oncol (2020). doi: 10.1001/jamaoncol.2020.1024
12. 王镔,赵刚. 脑胶质瘤免疫治疗的进展与展望[J]. 中国微侵袭神经外科杂志,2018,23(11):523-526. DOI:10.11850/j.issn.1009-122X.2018.11.014.
13. Current Immunotherapies for Gliblastoma Multiforme. Frontiers in Immunology.11:603911.doi:10.3389/fimmu.2020.603911
14. Schalper KA, Rodriguez‐Ruiz ME, Diez‐Valle R, et al. Neoadjuvant nivolumab modifies the tumor immune microenvironment in resectable glioblastoma[J]. Nat Med, 2019, 25(3):470‐476. DOI: 10.1038/s41591‐018‐0339‐5.
15. Cloughesy TF, Mochizuki AY, Orpilla JR, et al. Neoadjuvant anti‐PD‐1 immunotherapy promotes a survival benefit with intratumoral and systemic immune responses in recurrent glioblastoma[J]. Nat Med, 2019, 25(3):477‐486. DOI: 10.1038/s41591‐018‐0337‐7.
16. Barresi V, Simbolo M, Mafficini A, et al. Ultra-mutation in IDH wild-type glioblastomas of patients younger than 55 years is associated with defective mismatch repair, microsatellite instability, and giant cell enrichment[J]. Cancer (Basel), 2019,11(9):1279.DOI: 10.3390/cancers11091279.
17. Arming an Oncolytic Herpes Simplex Virus Type 1 with a Single-chain Fragment Variable Antibody against PD-1 for Experimental Glioblastoma Therapy. Clin Cancer Res; 25(1):290-299
18. Heimberger, A.B., Hlatky, R., Suki, D., et al. (2005) Prognostic Effect of Epidermal Growth Factor Receptor and EGFRvIII in Glioblastoma Multiforme Patients. Clinical Cancer Research, 11, 1462-1466.
https://doi.org/10.1158/1078-0432.CCR-04-1737
19. Schuster J, Lai RK, Recht LD, Reardon DA, Paleologos NA, Groves MD, et al. A phase II, multicenter trial of rindopepimut (CDX-110) in newly diagnosed glioblastoma: the ACT III study. Neuro Oncol (2015) 17:854–61. doi:10.1093/neuonc/nou348
20. 中国医师协会脑胶质瘤专业委员会,上海市抗癌协会神经肿瘤分会. 中国中枢神经系统胶质瘤免疫和靶向治疗专家共识(第二版)[J]. 中华医学杂志,2020,100(43):3388-3396. DOI:10.3760/cma.j.cn112137-20200714-02117.
21. Narita Y, Arakawa Y, Yamasaki F, et al. A randomized, double‐blind, phase Ⅲ trial of personalized peptide vaccination for recurrent glioblastoma[J]. Neuro Oncol, 2019,21(3):348‐359. DOI: 10.1093/neuonc/noy200.
22. Liau, L.M., Ashkan, K., Tran, D.D. et al. First results on survival from a large Phase 3 clinical trial of an autologous dendritic cell vaccine in newly diagnosed glioblastoma. J Transl Med 16, 142 (2018).
23. Batich K A , Mitchell D A, Healy P, et al. Once, Twice, Three Times a Finding: Reproducibility of Dendritic Cell Vaccine Trials Targeting Cytomegalovirus in Glioblastoma[J]. Clinical Cancer Research, 2020, 26(20):clincanres.1082.2020.
24. Kotaro Sugawara, et al. Efficacy of a Third-Generation Oncolytic Herpes Virus G47Δ in Advanced Stage Models of Human Gastric Cancer. Molecular Therapy Oncolytics, 2020,17:205-215.
25. Desjardins A, Gromeier M, Herndon JE 2nd, et al. Recurrent glioblastoma treated with recombinant poliovirus[J]. N Engl J Med, 2018, 379(2):150‐161. DOI: 10.1056/NEJMoa1716435.
26. Gregory K. Friedman, M.D., James M. Johnston, et al. Oncolytic HSV-1 G207 Immunovirotherapy for Pediatric High-Grade Gliomas. N Engl J Med 2021; 384:1613-1622. DOI: 10.1056/NEJMoa2024947
27. Cloughesy TF, Petrecca K, Walbert T, et al. Effect of Vocimagene Amiretrorepvec in Combination With Flucytosine vs Standard of Care on Survival Following Tumor Resection in Patients With Recurrent High-Grade Glioma: A Randomized Clinical Trial. JAMA Oncol. 2020;6(12):1939–1946.
28. Rahman MM, McFadden G. Oncolytic Virotherapy with Myxoma Virus. Journal of Clinical Medicine. 2020; 9(1):171. https://doi.org/10.3390/jcm9010171
29. 全脑放疗联合EGFR-TKIs 与联合化疗在非小细胞肺癌脑转移治疗中的疗效评价.
30. 杨沛,蔡永广. 非小细胞肺癌脑转移治疗进展[J]. 中国现代医生,2020,58(14):182-187,192.
31. 张佳玲,张凤春,徐迎春. 乳腺癌脑转移系统治疗的研究进展[J]. 上海交通大学学报(医学版),2021,41(5):671-677. DOI:10.3969/j.issn.1674-8115.2021.05.019.
【声明】
本文观点仅代表作者本人,不代表美柏医健立场,欢迎交流补充
以上信息转自 美柏医健